13. 아미노산 및 질소대사(2)
1. 아미노산 합성

• 일부 아미노산은 해당과정, 구연산회로 또는 오탄당 인산 회로의 중간산물로부터 합성됨
• 질소 : 글루탐산과 글루타민 형태로 생합성 경로에 들어감
• 아미노산과 뉴클레오티드의 생합성경로 : 조효소인 피리독살인산(PLP), 테트라하이드로엽산(THF), 5-아데노
실메티오닌(SAM)을 반복적으로 이용함
• PLP는 글루탐산을 포함한 아미노기 전이반응과 다른 아미노산으로의 전환에 필요
• THF, SAM은 1-탄소단위 전달반응에 필요함
• 대부분의 박테리아와 식물은 모든 20개의 표준 아미노산을 합성할 수 있지만, 포유류는 표준아미노산의 약
반만을 합성할 수 있음
• 비필수아미노산 : 대사의 중간산물 또는 필수아미노산으로부터 합성될 수 있음. 필수아미노산은 체내에서
합성할 수 없으므로 식이로부터 공급 필요
1) α-케토글루타르산으로부터 글루탐산, 글루타민, 프롤린, 아르기닌의 생합성
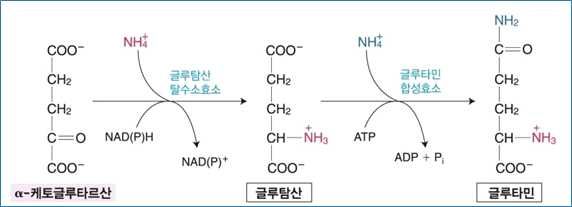
• 글루탐산은 글루탐산 합성효소와 글루탐산 탈수소효소에 의해 α-케토글루타르산으로부터 합성됨
• 글루타민은 글루타민 합성효소에 의해 글루탐산의 γ-카르복실기와 암모니아가 아미드결합을 형성함으로써
합성됨
• 이 반응은 ATP의 가수분해를 필요로하며, 글루타민을 합성하는 것 외에 뇌와 간에서 암모니아의 해독화를
위한 중요한 기전임
• 프롤린은 글루탐산의 고리화반응과 환원반응에 의해 합성됨
• 아르기닌은 오르니틴과 요소회를 경유하여 글루탐산으로부터 합성
2) 글리세린산 3-인산으로부터 세린, 글리신, 시스테인의 합성
• 세린 : 글리세린산 3-인산의 산화로 생성된 3-포스포하이드록시피루브산의 아미노기 전이반응과 인산에스
테르의 가수분해에 의해 합성
• 글리신 : PLP를 조효소로 필요로하는 세린 하이드록시메틸 전이효소에 의해 하이드록시메틸기의 제거로 합
성. 이 때, 세린의 β-탄소는 THF에 전달되어, N5, N10-메틸렌 THF이 생성됨
• 시스테인 : 2개의 아미노산으로부터 합성
• 메티오닌 : 황 원자를 제공하고, 세린은 탄소골격을 제공함
3) 피루브산으로부터 알라닌의 합성
• 알라닌은 피루브산과 글루탐산으로부터 알라닌 아미노전이효소(ALT)에 의해 합성됨
※ 알라닌 아미노전이효소 = 글루탐산 피루브산 아미노전이효소(glutamate pyrubate transaminase, GPT)
4) 옥살로아세트산으로부터 아스파르트산과 아스파라긴의 합성
• 아스파르트산 : 옥살로아세트산과 글루탐산으로부터 아스파르트산 아미노전이효소(AST)에 의해 합성됨
• 아스파라긴 : 아스파르트산으로부터 아스파라긴 합성효소에 의해 합성. 아미드공여체로서 글루타민이 필요
하며, ATP의 가수분해를 필요로 함
5) 리보오스 5-인산으로부터 히스티딘의 합성
• 히스티딘 : 5-인산리보실 1-피로인산(PRPP) (5개 탄소 공급원), ATP의 퓨린고리(1개의 질소와 1개의 탄
소), 글루타민(1개의 질소공급원)으로부터 합성됨
• 속도조절단계는 ATP 포스포리보실전이효소에 의한 PRPP와 ATP의 축합반응
6) 페닐알라닌으로부터 티로신의 합성
• 티로신 : 페닐알라닌 수산화효소에 의한 페닐알라닌의 페닐기 4번 탄소의 수산화반응을 통해 직접 합성될
수 있음
• 이 효소는 테트라하이드로비올테린(BH4)를 조효소로 필요로 함
2. 뉴클레오티드 분해
1) 뉴클레오티드의 구조
• 질소염기, 오탄당 및 1~3개의 인산기로 구성되어짐
• 질소함유 염기 - 퓨린, 피리미딘에 속함

(1) 퓨린과 피리미딘 구조
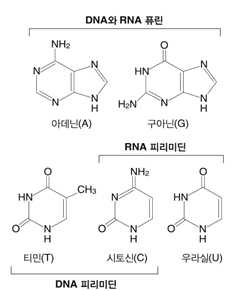
• DNA : 퓨린 염기(아데닌(adenine, A), 구아닌(guanine, G)), 피리미딘 염기(시토신(cytosine, C), 티민
(thymine, T))
• RNA : 퓨린 염기(아데닌(adenine, A), 구아닌(guanine, G)), 피리미딘 염기(시토신(cytosine, C), 우라실
(uracil, U))
(2) 뉴클레오시드
• 뉴클레오시드(nucleoside) = 염기 + 오탄당
• 당이 리보오스 → 리보뉴클레오시드(ribonucleoside)
• 당이 디옥시리보오스 → 디옥시리보뉴클레오시드(deoxyribonucleoside)
• A, G, C, U의 리보뉴클레오시드는 각각 아데노신, 구아노신, 시티딘, 우리딘
• A, G, C, T의 디옥시리보뉴클레오시드는 각각 디옥시아데노신, 디옥시구아노신, 디옥시시티딘, 디옥시티미
딘(티미딘)
• 염기와 당 고리에서 탄소는 질소원자와 다르게 번호가 붙여짐. 오탄당의 탄소는 1‘~5’로 번호가 붙여짐
(3) 뉴클레오티드

• 뉴클레오티드(nucleotie) = 뉴클레오시드 + 하나 이상의 인산기 첨가
• 첫 번째 인산기는 오탄당의 5‘ 탄소의 -OH에 에스테르결합에 의해 결합되고, 뉴클레오시드 5’-인산 또는
5‘-뉴클레오티드라고 부름
• 1개의 인산기가 당의 5‘-탄소의 -OH에 결합 → 뉴클레오시드 일인산(NMP)라고 함
• 2개 또는 3개의 인산기가 결합. 각각 뉴클레오시드 이인산(NDP), 뉴클레오시드 삼인산(NTP)이 됨
2) 퓨린 뉴클레오티드의 분해

• 식이로 섭취한 핵산 분해 → 소장에서 일어남
• 췌장효소가 뉴클레오티드를 뉴클레오시드와 유리질소 염기로 가수분해
• 퓨린 뉴클레오티드는 특정 효소에 의해 연속적으로 분해되어 최종산물인 요산이 생성됨
• RNA, DNA → 췌장에서 분비되는 리보뉴클레아제, 디옥시리보뉴클라에제에 의해 → 올리고뉴클레오티드로
분해함
• 올리고뉴클레오티드 → 췌장 포스포다이에스터라아제에 의해 더 가수분해 → 3‘, 5’-모노뉴클레오티드의 혼
합물을 생성
• 뉴클레오티다아제는 모노뉴클레오티드의 인산기를 제거하여 뉴클레오시드를 방출 → 소장 점막세포에서 흡
수 or 유리염기로 분해됨
• 식이 퓨린은 조직의 핵산 합성에 많이 이용되지 않음 → 대부분은 소장 점막세포에서 요산으로 전환 → 소
변으로 배설
• AMP : AMP 탈아미노효소 → 아미노기 제거 → IMP or 5‘-뉴클레오시다아제와 아데노신 탈아미노효소에
의해 이노신(inosine)으로 됨
• IMP, GMP : 5'-뉴클레오시다아제 → 뉴클레오시드 형태인 이노신, 구아노신으로 전환
• 이노신, 구아노신 : 퓨린 뉴클레오시드 가인산분해효소 → 각각 퓨린염기인 히포크산틴, 구아닌으로 전환
• 구아닌 : 탈아미노반응 → 크산틴 형성
• 히포크산틴 : 크산틴 산화효소 → 크산틴
• 크산틴 : 크산틴 산화효소 → 요산 → 소변으로 배설
• 퓨린 분해대사의 결함으로 몇 가지 질환이 생길 수 있음 → 통풍(gout)은 요산의 과잉 생성 또는 요산의 배
설 저하로 혈액에 요산농도가 높아진 것
• 고요산혈증 → 관절에 요산염 결정의 침착 → 급성 염증반응을 일으킴
• 요산염 결정 → 부드러운 조직에 침착 → 만성 결절성 통풍 → 신장에 요산 결석을 형성
• 요산이 과잉 생성되는 경우 → 요산 합성 저해제인 알로퓨리놀을 사용 → 체내에서 옥시퓨리놀로 전환 →
크산틴 산화효소를 저해 → 히포크산틴과 크산틴이 축적 → 이 물질들은 요산보다 잘 녹기 때문에 염증반응
이 시작되지 않음
3) 피리미딘 뉴클레오티드의 분해
• 피리미딘 고리는 분해되어 매우 잘 녹는 생성물인 β-알라닌, β-아미노이소부티르산 → 최종적으로 NH3,
CO2를 생성함
• 시티딘, 디옥시시티딘은 시티딘 탈아미노효소 → 탈아미노반응 → 우리딘, 디옥시우리딘으로 전환
• 우리딘, 디옥시우리딘은 뉴클레오시드 가인산 분해효소 → 우라실로 분해
• 디옥시시티딘 일인산(dCMP)는 5‘-뉴클레오티다아제 → 디옥시우리딘 일인산(dUMP)이 됨
• 디옥시우리딘 일이산(dUMP)은 5‘-뉴클레오티다아제, 뉴클레아시드 가인산분해효소 → 티민(T)이 됨
• 우라실, 티민 → 최종산물인 β-알라닌, β-아미노이소부티르산으로 전환
• 첫 단계에서 우라실, 티민은 다이하이드로피리미딘 탈수소효소의 촉매작용에 의해 다이하이드로유도체로 환
원됨
• 이들 유도체의 가수분해로 고리가 열리면서 각각 N-카르바밀-β-알라닌, N-카르바밀-β-아미노이소부티르산
이 됨
• β-우레이도프로피나아제의 촉매에 의한 탈아미노반응으로 각각 β-알라닌, β-아미노이소부티르산이 생성됨
• 계속 분해되어 NH3, CO2를 생성함
3. 뉴클레오티드 합성
• 뉴클레오티드는 모든 세포에서 여러 가지 중요한 기능을 함
• 핵산인 DNA, RNA의 구성단위
• 화학에너지 운반체, 주로 ATP가 화학에너지의 운반체이고, GTP도 일부 반응에서 화학에너지의 운반체역할
을 함
• 조효소인 NAD, FAD, SAM 및 조효소 A(CoA)의 구성성분
• UDP-글루코오스, CDP-다이아실글리세롤과 같은 생합성 중간산물의 구성성분
• cAMP, cGMP 세포의 2차 전령으로 작용
※ 2차 전령 : 세포 표면에 수용체에 결합하는 호르몬에 반응하여 세포가 방출하는 물질로 세포 내 실질적
인 반응을 유도함
• 뉴클레오티드 합성에는 신생합성경로 & 구제경로 2가지가 있음
- 신생합성경로 : 아미노산, 리보오스 5-인산, CO2, NH3의 대사전구체로부터 시작
- 구제경로 : 핵산 분해로 방출된 유리 염기와 뉴클레오시드를 재사용하는 경로
1) 퓨린뉴클레오티드 합성

(1) 퓨린의 신생합성경로 : ① IMP의 합성
• 퓨린 고리는 아스파르트산, 글리신, 글루타민, 이산화탄소, N10-포르밀 THF으로부터 합성
• 퓨린 합성 첫 단계 : 리보오스 5-인산 → 5-인산리보실 1-피로인산(PRPP)을 생성하는 반응
• 이 반응은 PRPP 합성효소에 의해 촉매, 다른자리입체성 조절에 의해 조절됨
• PRPP에 글루타민의 아미노기 전이 → 5-인산리보실아민이 합성 → 이 반응은 글루타민-PRPP 아미드전이
효소에 의해 촉매, 되먹임 억제에 의해 조절
• 5-인산 리보실아민은 글리신아미드 리보뉴클레오티드 합성효소에 의해 → 글리신의 카르복실기와 5-인산
리보실아민의 아미노기 사이에 아미드 결합을 형성 → 글리신아미드 리보뉴클레오티드가 됨
• 다음 8단계의 후속반응을 통해 이노신산(IMP)이 합성됨
② IMP에서 AMP 또는 GMP로의 전환

• 2단계 반응, 에너지를 필요로 함
• AMP의 합성은 GTP를, GMP의 합성은 ATP를 사용함
• IMP → AMP 전환 : 먼저 아데닐로숙신산을 생성 → 아데닐로숙신산 분해효소에 의해 → 푸마르산 제거 →
AMP로 됨
• IMP → GMP 전환 : IMP 탈수소효소에 의해 → 크산토신 일인산(XMP)를 생성 → XMP-글라타민 아미드전
이효소에 의해 → 글루타민의 아미노질소를 받아 → GMP로 됨
③ 퓨린 뉴클레오티드 합성의 조절

• 퓨린 합성 → 다른자리입체성 조절. 되먹임 억제에 의해 조절됨
• 다른자리입체성 조절기전 : PRPP 합성효소에 의한 PRPP 합성의 조절, 이 효소는 음성 조절인자인 ADP와
GDP에 의해 조절
• 3가지 되먹임 억제 기전 : 퓨린 뉴클레오티드의 전체속도와 2개의 최종생성물인 AMP와 GMP 생성의 상대
적인 속도를 조절하는데 협동적으로 작용
• 첫 번째 조절 기전 : 첫 단계 반응에 작용
• 글루탐산-PRPP 아미도 전이효소 → 최종 생성물인 IMP, AMP 및 GMP에 의해 저해
• AMP & GMP : 협동적인 저해, AMP or GMP가 과잉축절될 때, 글루탐산-PRPP 아미드 전이효소는 부분적
으로 저해
• 두 번째 조절 기전 : 과량의 GMP → IMP 탈수소효소 저해, AMP 생성에는 영향을 주지 않음
• AMP의 축적 → 아데닐로숙신산 합성효소 저해, GMP 생합성에 영향을 주지 않음
• 세 번째 조절 기전 : GTP IMP에서 AMP로의 전환에 필요, ATP는 IMP에서 GMP로의 전환이 필요 → 상호
조절으로 두 가지 뉴클레오티드 합성의 균형을 맞춤
(2) 퓨린의 구제경로

• 대상 : 핵산이 분해되어 생성된 퓨린, 식이로 섭취하여 분해되지 않은 퓨린
• 2가지 효소가 관여 : 아데닌 포스포리보실 전이효소(ARPT), 히포크산틴-구아닌 포스포리보실 전이효소
(HGPRT)
• PRPP를 리보오스 5-인산기의 급원으로 이용
(3) 뉴클레오시드 일인산의 뉴클레오시드 삼인산으로의 전환
• 일반적으로 생합성에 사용되는 뉴클레오티드 일이산 → 뉴클레오시드 삼인산으로 전환됨
• 이 전환 경로는 모든 세포에 공통


- 뉴클레오시드 일이산 : 뉴클레오시드 일인산 키나아제에 의해 → 다른 뉴클레오시드 이인산으로 전환. 이
효소들은 염기에 특이적이지만 당(리보오스 또는 디옥시리보오스)에는 비특이적
- 뉴클레오시드 이인산 : 뉴클레오시드 이인산 키나아제에 의해 → 뉴클레오시드 삼인산으로 전환. 이 효소
는 염기(퓨린 또는 피리미딘) 또는 당(리보오스 또는 디옥시리보오스)에 비특이적
- 호기적 상태에서 ATP가 다른 뉴클레오시드 삼인산보다 높은 농도로 존재 → 대부분 ATP가 인산기 공여
체로 이용
※ 뉴클레오시드 일이산 키나아제
- AMP 키나아제(AMP kinase) : AMP + ATP ⇋ 2ADP
- GMP 키나아제(GMP kinase) : GMP + ATP ⇋ GDP + ADP
※ 뉴클레오시드 이인산 키나아제
- GDP + ATP ⇋ GTP + ADP
- CDP + ATP ⇋ CTP + ADP
2) 피리미딘 뉴클레오티드 합성
• 피리미딘 고리는 리보오스 5-인산에 결합하기 전에 합성됨
• 피리미딘 고리의 원자 → 글루타민, CO2, 아스파르트산에서 유래
• 피리미딘 리보뉴클레오티드 : 시티딘 5‘-일인산(CMP), 우리딘 5’-일이산(UMP)
(1) 피리미딘 뉴클레오티드의 신생합성경로
① 피리미딘 염기와 뉴클레오티드의 합성경로
• 피리미딘 뉴클레오티드 생합성은 글루타민과 CO2로부터 카르바모일 인산 합성으로부터 시작함
• 이 반응은 카르바모일 합성효소 II에 의해 촉매됨. 피리미딘 생합성 조절 효소, 최종생성물인 UTP에 의해
저해되거나, ATP, 5-인산 리보실 1-피로인산(PRPP)에 의해 활성화됨. 비오틴을 필요로 하지 않음
• 두 번째 단계 : 아스파르트산 카르바모일전이효소에 의해 카르바모일 인산과 아스파르트산이 반응 → N-카
르바모일 아스파르트산을 생성함
• N-카르바모일 아스파르트산은 다이하이드로오로타아제에 의해 가수분해 → 피리미딘 고리가 닫혀 다이하이
드로오로트산이 됨
• 다이하이드로오로트산은 다이하이드로오로트산 탈수소효소에 의해 산화 → 오로트산 → 오로트산 + 오로트
산 포르포리보실 전이효소 → 오르티딘 5‘-인산(OMP)을 생성함
• OMP + OMP 탈카르복실화효소 → 우리딘 일인산(UMP)로 전환
• UMP + 키나아제 → 인산화 → UTP
• UTP + CTP 합성효소 → CTP 생성. 1개의 ATP와 질소공여체인 글루타민을 필요로 함
② 리보뉴클레오티드로부터 디옥시리보뉴클레오티드로의 전환
• DNA 합성에 필요한 뉴클레오티드는 2‘-디옥시리보뉴클레오티드
• 리보뉴클레오티드 이인산으로부터 리보뉴클레오티드 환원효소에 의해 생성됨
• 리보뉴클레오티드 환원효소는 뉴클레오시드 이인산(ADP, GDP, CDP, UDP)를 디옥시형새(dADP, dGDP,
dCDP, dUDP)로 환원하는데 특이적
• 2‘-수산화기의 환원에 필요한 수소원자는 효소 자체에 있는 2개의 술프하이드릴기에 의해 공급
• 티미딜산(dTMP)은 dCMP, dUMP으로부터 합성됨
• dUMP + 티미딜산합성효소 → dTMP로 전환됨
• 이 반응은 테트라하이드로엽산(THF)이 다이하이드로엽산(DHF)으로 산화가 일어나면서 1-탄소단위전달과 환
원반응이 일어나는 특이적인 반응으로, 메틸기의 공급원은 N5, N10-메틸렌 THF
• 티미딜산 합성효소는 항암제인 5-플루오로우라실과 같은 티민 유사물질에 의해 저해
• 다이하이드로엽산 환원효소는 항암제인 메트트렉사트같은 엽산 유사물질에 의해 저해됨
(2) 피리미딘 염기의 구제경로
• 구제경로는 거의 없음
• 피리미딘 뉴클레오시드는 뉴클레오시드에서 뉴클레오티드로의 인산화과정에서 ATP를 이용하는 뉴클레오시
드 키나아제에 의해 재사용될 수 있음
4. 신경전달물질 대사
1) 신경전달물질의 분해
• 많은 중요한 신경전달물질은 아미노산에서 유도되는 1차 또는 2차 아민임
• 정보전달에 중요한 역할을 함
• 방출 후 시냅스 간극으로부터 신속히 분해되거나 제거되어야 정보전달이 원활하게 됨
• 카테콜아민(catecholamine) : 도파민, 노르에피네프린, 에피네프린이 있는 생체 활성아민(티로신으로부터 합
성)
※ 카테콜아민
• 부신에서 스트레스에 반응하여 분비되는 교감신경자극작용 호르몬
• 1개의 카테콜기(catechol group)을 포함하고 티로신(tyrosine)으로부터 유도되기 때문에 카테콜아민이라고
부름
- 노르에피네프린 : 교감신경계의 신호전달 작용을 하는 부신수질의 크로마핀 세포에 있는 티로신으로부터
합성되는 호르몬, 간의 중성 지질과 글리코겐의 분해 촉진, 심박출량과 혈압 증가
- 에피네프린 : 스트레스에 대한 반응으로 부신 수질에서 분비되는 호르몬, 심박출량과 혈압 증가, 간의 글
리코겐과 지방의 분해 촉진
• 카테콜아민은 모노아민 산화효소(MAO)에 의한 산화적 탈아미노반응과 카테콜-O-메틸전이효소(COMT)에 의
한 O-메틸화반응에 의해 불활성화됨
• MAO 반응의 알데히드 생성물은 각각의 산으로 됨
• 에피네프린과 노르에피네프린 → 바닐릴만델산 생성
• 도파민 → 호모바닐릴산 생성
• 소변으로 배설
• 세로토닌(5-HT)은 뇌의 시상하부에서 분비되는 신경전달물질
• 섭식을 저해하는 중추신경계의 다양한 세포에서 발견
• 기분, 체온 조절, 고통 인식 및 수면 등에 영향을 줌
• MAO에 의해 산화되어 5-3-아세트알데히드를 생성한 후, 알데히드 탈수소효소에 의해 5-하이드록시인돌
3-아세트산으로 산화됨
2) 신경전달물질의 합성
• 티로신으로부터 합성 ; 도파민, 노르에피네프린, 에피네프린
• 티로신은 티로신 수산화효소에 의해 수산화되어 → 3,4-다이하이드록시페닐알라닌(DOPA) 합성
• 이 반응은 테트라하이드로비옵테린(BH4)이 필요하며 속도조절단계임
• DOPA는 DOPA 탈카르복실화효소에 의해 → 도파민 형성
• 도파민은 구리를 함유한 도파민 β-수화효소에 의한 수산화 반응 → 노르에피네프린 생성
• 노프에피네프린은 페닐에탄올아민 N-메틸전이효소에 의한 N-메틸화반응 → 에피네프린 생성
• γ-아미노부티르산(GABA)은 중추신경계에서 억제성 신경전달물질로 글루탐산의 탈카르복실화 반응에 의해
생성
• 이 반응은 피리독살인산(PLP)을 조효소로 필요로하는 글루탐산 탈카르복실화효소에 의해 촉매됨
• 세로토닌은 체매 여러 부위에서 트립토판으로부터 합성되고 저장
• 트립토판 수산화효소에 의한 수산화반응, 5-하이드록시트립토판 탈카르복실화효소에 의한 탈카르복실화 반
응 → 세로토닌 생성
• 히스타민 : 알레르기, 염증반응, 위산분비 자극, 뇌의 부위에서 신경전달을 중재하는 화학적 전령
※ 화학적 전령 : 전달암호(message)를 전달하는 화합물. 호르몬, 신경전달물질, 신경펩티드를 포함
• PLP를 조효소로 필요로하는 히스티딘 탈카르복실화효소에 의한 히스티딘의 탈카르복실화반응에 의해 생성
• 일산화질소(NO) : 신경전달물질, 혈관 확장, 혈소판 응집의 저해제 및 대식세포의 살균 등에서 중요한 역할
을 하는 광범위한 생리적 매개물질
• NO 합성효소에 의해 촉매되는 NADPH-의존성 반응에 의해 아르기닌으로부터 합성
5. 헴 대사
1) 헴의 분해
• 포르피린(porphyrin) : 금속이온, 보통 Fe2+ 또는 Fe3+와 쉽게 결합하는 고리 화합물
※ 포르피린 : α-탄소원자들에서 4개의 변형된 피롤고리가 메테닐 다리(methenyl bridges)로 연결된 이종고
리 고분자(heterocyclic molecule)
• 사람에서 가장 우세한 철 함유 금속포르피린은 헴(heme)
• 헤모글로빈, 미오글로빈, 시토크롬, 카탈라아제 및 트립토판 피롤라아제의 보결분자단임
• 헴단백질은 쉽게 합성되고 분해됨
• 적혈구는 생성된지 약 120일 후, 간과 지라의 망상내피계의 의해 분해됨
• 헴의 분해 첫 번째 단계 : 망상내피세포의 헴 산화효소계의 의해 촉매됨 → 이 효소계는 NADPH와 O2의 존
재하에 2개의 피롤고리(pyrrole ring) 사이의 메테닐 다리에 수산기를 첨가하고, Fe2+ 또는 Fe3+로 산화됨
※ 피롤고리(pyrrole ring) : 이종고리(heterocyclic) 방향족 유기화합물, C4H4NH의 5원자로 된 고리 구조
• 헴 산화효소계에 의한 두 번째 산화로 포르피린 고리가 분해됨 → Fe3+와 CO 방출 → 초록색 색소인 빌리
버딘 생성
• 빌리버딘은 빌리버딘 환원효소에 의해 환원 → 적황색인 빌리루빈을 생성함
• 빌리루빈과 그 유도체는 총체적으로 담즙색소라고 부름
• 빌리루빈은 혈장에서 약간만 용해되므로 유화제 역할을 하는 알부민과 비공유결합하여 간으로 운반됨
• 빌리루빈은 운반체 알부민으로부터 분리 → 간세포로 들어감
• 빌리루빈은 글루쿠로닐 간이효소에 의해 → 2분자의 글루쿠론산이 빌리루빈에 첨가 → 빌리루빈의 다이글루
쿠로니드가 됨
2) 헴의 합성
• 간은 헴 생합성의 주요 부위로 많음 헴단백질을 합성, 골수의 적혈구 생성세포는 헤모글로빈 합성을 활성화
함
• 간에서 헴 합성속도는 매우 다양, 적혈구에서 헴 합성속도는 상대적으로 일정하고 글로빈 합성속도에 맞추
어 진행됨
• 포르피린 생합성의 첫 단계, 마지막 세 단계는 미토콘드리아에서 일어나지만, 그 외 중간단계는 세포질에서 일어남
• δ-아미노레블린산(ALA) 합성효소에 의해 글리신과 숙시닐 CoA의 축합반응 → ALA 형성
• 이 반응은 조효소 PLP을 필요로하고, 포르피린 생합성의 속도조절단계
• 적혈구 합성이 감소 & 포르피린 생성이 글로빈의 농도를 초과할 때, 헴은 축적되고 Fe2+가 Fe3+으로 산화되
어 헤민(hemin)으로 전환됨
• 헤민은 ALA 합성효소의 활성을 감소시킴
• 2분자의 ALA의 축합반응으로 포르포빌리노겐을 생성(세포질) → 이 반응은 ALA 탈수소효소에 의해 촉매되
고 중금속 이온(납)에 의해 저해됨
• 4개의 포르포빌리노겐의 축합반응 → 선형의 테트라피롤인 하이드록시메틸빌란 생성 → 우로포르피리노겐
III 합성효소의 이성질화반응과 고리화반응 → 비대칭성인 우로포르피리노겐 III 생성
• 우로포르피리노겐 III은 아세틸기의 탈카르복실화 반응에 의해 코프로포르피리노겐 III이 됨
• 코프로포르피리노겐 III는 미토콘드리아로 들어감
• 미토콘드리아로 들어온 코프로포르피리노겐 III은 탈카르복실화 반응에 의해 → 2개의 프로피온산 곁사슬이
비닐기(vinyl)가 되어 프로토포르피리노겐 IX 생성되고 산화됨
• 프로토포르피린 IX로 철(Fe2+)이 자발적으로 삽입될 수 있으나 페로킬라타아제에 의해 속도로 빨라짐
• 포르피린증(prophyria)은 포르피린 생합성경로의 효소들의 유전적 결손으로 중간산물이 축적되고 생기는 질
환으로 빈혈증세와 신경학적 합병증 또는 피부합병증의 증세가 나타남
<확인문제>
문제 1. 다음 중 헤모글로빈(hemoglobin)의 구성성분으로 옳지 않은 것은?
① 단백질
② 헴
③ 구리
④ 포르피린
정답 ③
문제 2. 다음 중 아미노산 생합성에 대한 설명으로 옳은 것은?
① 질소는 글루탐산의 형태로만 생합성경로에 들어간다.
② 아미노산과 뉴클레오티드의 생합성경로는 PLP, THF, SAM을 반복적으로 이용한다.
③ 포유류는 표준아미노산을 모두 합성할 수 있다.
④ 필수아미노산은 대사의 중간산물 또는 필수아미노산으로부터 충분히 합성될 수 있고, 비필수아미
노산은 합성되려면 식이로부터 공급되어야 한다.
정답 ②
문제 3. 다음 중 α-케토글루타르산으로부터 합성되는 아미노산으로 옳은 것은?
㉮ 글루탐산
㉯ 글루타민
㉰ 프롤린
㉱ 이눌린
① ㉮㉯㉰
② ㉮㉰
③ ㉯㉱
④ ㉮㉯㉰㉱
정답 ①
문제 4. 신경전달물질의 합성에서 관여하지 않는 효소는 무엇인가?
① 티로신 수산화효소
② 도파민 β-수산화효소
③ NO 합성효소
④ 카르바모일 인산 합성효소 II
정답 ④
문제 5. 헴의 분해과정과 담즙생성 순서로 옳은 것은?
① 피롤고리 사이의 수산기 첨가 → 포르피린 고리 분해 → 빌리루빈 생성 → 빌리버딘 생성
② 피롤고리 사이의 수산기 첨가 → 포르피린 고리 분해 → 빌리버딘 생성 → 빌리루빈 생성
③ 피롤고리 사이의 수산기 첨가 → 포르피린 고리 합성 → 빌리버딘 산화 → 빌리루빈 환원
④ 피롤고리 사이의 수산기 첨가 → 포르피린 고리 합성 → 빌리버딘 환원 → 빌리루빈 산화
정답 ②
'생화학' 카테고리의 다른 글
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 15. 핵산의 복제와 유전자의 전사 및 발현 (0) | 2022.05.05 |
|---|---|
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 14. 핵산의 구조와 기능 (0) | 2022.05.04 |
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 12. 지질 대사(2) & 아미노산 및 질소대사(1) (0) | 2022.05.02 |
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 11. 지질 대사(1) (1) | 2022.05.01 |
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 10. 지질 (0) | 2022.04.30 |



