12. 지질 대사(2) & 아미노산 및 질소대사(1)
지질대사(2)
※ 들어가기
• 콜레스테롤 혈중 농도 ↑ → 심혈관계질환 발생 위험률 ↑ → 건강을 위협하는 위험스러운 물질로 주목함
• 콜레스테롤은 세포막의 주요 성분, 스테로이드 호르몬, 비타민 D 및 담즙산 생성의 전구체로 작용하는 매우
필수적인 물질
• 체내 세포는 식사로부터 섭취와 생합성을 통해 콜레스테롤을 지속적으로 공급받으며 그 과정은 적절한 기전
에 의해 조절됨
1. 콜레스테롤의 대사
1) 콜레스테롤의 합성
(1) 콜레스테롤의 합성경로
• 거의 대부분의 조직에서 콜레스테롤 합성이 가능하나 간, 장, 부신 정소 및 난소에서 합성량이 많음
• 특히 간은 가장 대표적인 합성 기관임
• 콜레스테롤은 긴 사슬 지방산처럼 아세틸 CoA와 NADPH로부터 합성되나 그 과정은 매우 다름
• 합성은 소포체 막과 세포질에 존재하는 효소들에 의해 이루어짐
① HMG CoA의 합성

• 피루브산이나 지방산 산화에 의해 생성된 아세틸 CoA 세 분자 + 티올라아제 + HMG CoA 합성효소의 작용
에 의해 순차적으로 축합 → HMG CoA 합성
• 케톤체 합성경로에서의 HMG CoA 합성과 매우 유사하나 케톤체 합성은 미토콘드리아에서 진행되는 반면
• 이 과정은 세포질에서 진행됨
② 메발론산의 합성

• HMG CoA 환원효소에 의해 두 분자의 NADPH가 이용되면서 HMG CoA가 메발론산으로 환원됨
• 콜레스테롤 합성의 속도조절단계, 활면소포체의 세포질 쪽 표면에 위치하는 HMG CoA 환원효소가 반응률을
조절하는 주요 효소임
• HMG CoA 환원효소는 콜레스테롤의 공급수준에 의해 조절
• 고콜레스테롤혈증 치료에 사용되는 스타탄의 작용대상이기도 함
③ 활성화된 이소프렌 단위로 전환

• 세 개의 ATP를 투입하여 탈탄산반응과 인산기 전이에 의해 메발론산을 두 종류의 활성화된 이소프렌 단위
로 전환
• 연속적 인산화 반응은 분자의 용해성을 증가시킴
• 이소프렌 단위는 탄소 5개로 이루어진 화합물로 먼저 이소펜티니 피로인산(IPP)를 만듦
• 이 후, 이성질화효소에 의해 다이메틸알릴피로인산(DPP)로 전환될 수 있음
④ 스쿠알렌 합성
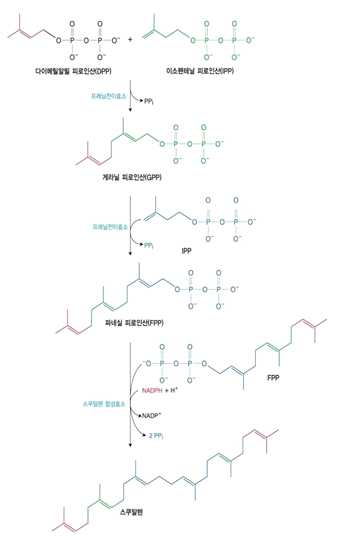
• 활성화된 이소프렌 단위 6개가 축합하여 스쿠알렌(C30)을 합성
• IPP + DPP 축합 → 게라닌 피로인산(GPP:C10)을 만듦, 방출된 피로인산이 가수 분해되므로 반응은 비가역
적
• GPP + IPP 축합 → 파네실 피로인산(FPP:C15)합성, 전이효소가 작용함
• 두 분자의 FPP 축합 → 스쿠알렌(C30) 합성, 전자공여체로 NADPH를 사용하며, 스쿠알렌 합성효소가 작용
⑤ 콜레스테롤 합성
• 스쿠알렌은 산소와 NADPH를 이용하여 고리화된 첫 스테롤 화합물인 라노스테롤 → 연속적인 단계를 거쳐
콜레스테롤로 전환됨
• 콜레스테롤은 소포체 표면에 위치한 아실 CoA : 콜레스테롤 아실전이효소(ACAT)에 의해 지방산이 전이되
어 콜레스테롤 에스테르를 만듦
• 콜레스테롤 에스테르는 콜레스테롤보다 더 소수성인 형태로 간세포에 저장 or 지단백질에 포함되어 필요한
다른 조직으로 이동
• 스쿠알렌 일산화효소 → 산소분자로부터 한 개의 산소원자를 스쿠알렌 고리에 붙여 스쿠알렌 에폭시드를 형
성
• 옥시도스쿠알렌 고리화효소(라노스테롤 합성효소)의 작용에 의해 고리화 진행 → 4개의 융합된 고리구조를
갖는 라노스테롤이 됨
• 라노스테롤이 콜레스테롤로 전환되는 데는 약 20개의 후속반응이 필요함 → 4번 위치의 메틸기 2개, 14번
위치의 에틸기 1개 제거, 이중결합의 이동(8→5), 이중결합(24번 위치)의 환원이 일어나면서 탄소 고리가
30개에서 27개로 짧아짐
(2) 콜레스테롤 생합성의 조절
• 콜레스테롤 생합성과 이동은 여러 기전에 의해 조절됨
• 생합성 과정은 HMG CoA를 메발론산으로 전환시키는 HMG CoA 환원효소가 주요 속도조절단계로 작용하
며, 여러 기전에 의한 대사적 조절을 받음
① 유전자 발현 변화에 의한 조절
• 세포 내 콜레스테롤 수준 ↓ → HMG CoA 환원효소의 발현 증가 → 콜레스테롤 합성 증가
• 세포 내 콜레스테롤 수준 ↑ → HMG CoA 환원효소의 전사 활성화 되지 못함 & LDL수용체의 유전자 전사
가 감소되어 혈액으로부터 콜레스테롤 유입이 줄어듬
② 호르몬에 의한 조절
• 인슐린은 HMG CoA 환원효소의 발현을 증가시킴
• 글루카곤은 억제하는 효과가 있음
③ 인산화에 의한 효소 활성 변화에 의한 조절
• 세포 내 ATP 수준 ↓ → AMP 농도 ↑ → 단백질 키나아제(AMPK) 활성화 → HMG CoA 환원효소가 인산화
→ 효소활성 억제 → 콜레스테롤 합성 억제
④ 효소의 분해에 의한 조절
• 세포 내 콜레스테롤 수준 ↑ → HMG CoA 환원효소 분해 촉진
• 콜레스테롤 생합성의 전구체인 라노스테롤 증가 → HMG CoA 환원효소 분해 촉진
(3) 스테로이드 호르몬의 합성

• 콜레스테롤은 모든 스테로이드 호르몬의 전구물질
- 스테로이드 호르몬 : 부신피질에서 만들어짐(미네랄코르티코이드, 글루코코르티코이드), 정소&난소에서
만들어지는 성호르몬(프로게스테론, 안드로겐, 에스트로겐)
- 미네랄코르티코이드(부신피질) : 신장에서 무기이온(Na+, Cl-, HCO3-)의 재흡수를 조절
- 글루코코르티코이드(부신피질) : 당신생 조절, 단백질과 탄수화물대사에 영향을 주고 면역반응과 염증반
응에 참여
- 성호르몬(프로게스테론, 안드로겐, 에스트로겐) : 이차 성징 발현, 여성의 생리 주기 조절
• 스테로이드 호르몬들은 모두 콜레스테롤에서 전환된 프레그네놀론, 프로게스테론이라는 공통의 전구물질을
통해 만들어짐
• 첫 반응(콜레스테롤의 프레그네놀론으로의 전환) : 미토콘드리아의 데스몰라아제 효소에 의해 촉매, 속도조
절단계로 작용
→ 데스몰라아제는 2개의 수산화효소로 구성된 효소복합체, 콜레스테롤의 곁사슬에 NADPH와 산소분자를
이용하여 수산화를 유도, 그 사이의 결합을 끊어 곁사슬을 제거함
→ 합성된 프레그네놀론 소포체로 운반되어 산화되고 이성질화되어 프로게스테론이 됨
• 프로게스테론은 다른 스테로이드 호르몬의 전구체 + 그 자신이 호르몬으로서 작용함
→ 주로 수정란의 착상, 성숙을 돕고 임신 기간 동안 태반에서 다량 생산되어 자궁 평활근의 수축을 막아
임신을 유지시킴
2) 콜레스테롤의 수송과 지단백질의 대사
• 콜레스테롤은 수용성이 아니라서 조직 내에 저장
• 호르몬, 담즙산 및 비타민 D 등으로 합성되기 위해서는 → 지단백질의 형태로 운반되어야 함
• 저밀도지단백질(LDL) & 고밀도지단백질(HDL)이 콜레스테롤의 수송과 대사에 중요한 역할을 함
(1) LDL의 대사
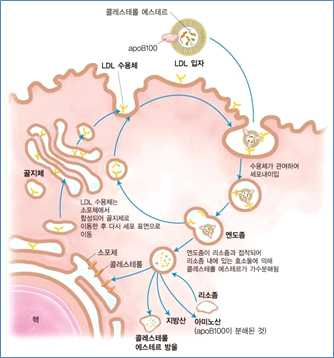
• LDL은
- 혈중 콜레스테롤의 약 60%가 결합된 콜레스테롤의 주요 운반체임
- 간에서 만들어진 VLDL이 말초조직에서 지단백질 리파아제(LPL)에 의해 주요성분인 중성지방에 제거되면
서 전환된 것
- 중성지방 함량 콜레스테롤과 콜레스테롤 에스테르가 주요 성분
- apoB100을 주요 아포지단백질을 가지고 있어 apoB100을 인지하는 세포막 LDL수용체가 있는 간 외 조
직으로 콜레스테롤을 운반함
• LDL의 apoB100 & LDL수용체 간의 상호작용이 LDL의 세포 내 이입(endocytosis)에 결정적으로 중요함
• LDL수용체 → 소포체에서 합성, 골지체에서 가공 및 성숙된 후 세포막으로 표적화됨
• LDL + LDL 수용체 결합 → 세포 내로 함입 → 엔도좀(endosome)을 만들고 리소좀과 결합 → 콜레스테롤,
지방산, 아미노산 및 인지질 등으로 가수분해 → LDL 수용체는 세포표면으로 돌아가 다시 LDL 흡수에 이용
됨
• 세포 내로 들어온 콜레스테롤 → 세포막의 구성물질, 스테로이드 호르몬 및 담즙산의 전구체로 사용 or
ACAT에 의해 콜레스테롤 에스테르로 전환되어 세포 내에 저장됨
• 충분한 양의 콜레스테롤의 세포 내로 들어오면 콜레스테롤의 생합성 속도 ↓ → LDL수용체 합성을 억제함으
로써 세포 내에 더 이상 과량의 콜레스테롤이 들어오지 못하도록 조절함
• 이러한 조절작용은 손상된 혈관벽의 대식세포에서는 제대로 기능을 못함
• 혈관 상피세포에 손상 → 단핵구가 상피세포에 부착되어 내막 쪽으로 이동 → 대식세포로 전환
• 대식세포에 있으며 산화된 LDL과 친화도가 높은 수용체는 콜레스테롤 농도에 의해 조절되지 않음 → 대식
세포 내에 콜레스테롤 축전 거품세포(foam cell)로 변형되어 동맥경화성 플라크(plque)를 형성함

(2) HDL의 대사

• HDL은 콜레스테롤을 조직에서 간으로 이동
- 담즙산으로 전환하여 배출할 수 있게 함
- 조직 내의 과다한 콜레스테롤 축적을 막을 수 있음
• 단백질이 풍부한 작고 납작한 원반형의 지단백질로 생성되어 혈류로 배출됨
• 신생 HDL(nascent HDL)에 있는 apoAI이 혈장 효소인 레시틴 : 콜레스테롤 아실전이효소(LCAT)를 활성화
시킴
• LCAT → 레시틴(포르파티딜콜린)의 2번 위치에 부착된 지방산을 콜레스테롤로 전이시켜 콜레스테롤 에스테
르를 생성하는 효소
• 생성된 콜레스테롤 에스테르는 소수성 → HDL중심부에 축적 → 납작한 원반형의 신생 HDL 형태로부터 점
차로 둥근 미셀 형태의 HDL로 전환됨
• 콜레스테롤 에스테르가 풍부한 HDL 수용체 의존성 세포 내 이입 방법으로 직접적으로 간세포 내로 들어가
거나, 스테로이드 호르몬을 만드는 세포 또는 간세포의 막수용체에 결합 → 콜레스테롤을 세포 내로 이동시
킴
• HDL은 간 외 조직의 콜레스테롤과 결합 → 간으로 운반 → 담즙 생성에 사용할 수 있게 하는 콜레스테롤
역수송 역할을 함
• 조직의 콜레스테롤 과다 축적을 막기 때문에 항동맥경화성 콜레스테롤 수송체로 작용함
(3) 콜레스테롤의 분해
• 콜레스테롤의 고리구조는 다른 분자와는 달리 더 작은 분자로 분해되지 않음
• 스테롤 핵이 용해성이 더 좋은 담즙산과 담즙산염을 형성 → 대변에 섞여 체외로 배설할 수 있음
• 담즙 : 간 세포에서 생성, 지질의 소화를 돕는 물질 → 콜레스테롤, 인지질, 담즙산염 및 헴의 분재산물인
담즙색소로 구성되어짐
• 생성된 담즙 단관을 통해 담낭에 저장 → 지질의 소화를 위해 필요할 때 심이지장으로 분비 → 유화제로 작
용함
• 담즙산염 : 담즙산이 접합(conjugation)되어 만들어진 물질, 높은 용해성 & 양쪽성 특성을 가짐 → 유화제로
작용
3) 담즙산과 담즙산염의 합성


• 담즙산 형성 : 간에서 진행됨
• 가장 중요한 속도조절단계 : 콜레스테롤 7-α-하이드로콜레스테롤이 되는 반응, 소포체에 존재하는 콜레스테
롤 7-α-수산화효소에 의해 촉매됨
• 여러 단계에 반응을 거쳐 수산기(-OH)첨가, 이중결합 환원, 탄화수소 사슬 짧아짐, 카르복실기(-COO-)가
곁사슬에 첨가 → 담즙산 생성
• 담즙산은 한 분자 내에 극성과 비극성 부분을 모두 가지는 양쪽성 물질 → 콜산(cholic acid)과 디옥시콜산
(deoxycholic acid)이 대표적인 물질
• 속도조절단계는 콜레스테롤에 의해 촉진되고 최종 생성물인 콜산에 의해 억제됨
• 생성된 담즙산은 간에서 글리신 or 타우린과 결합 → 담즙산염을 만듬
• 담즙산염 : 글리신의 카르복실기나 타우린의 황산기(SO4-)가 생리적 pH에서 이온화하므로 양쪽성이 더욱 커
져 담즙에서 유화제로 작용할 수 있게 됨
4) 담즙산염의 장간순환(enterohepatic circulation)
• 소장에서 지질의 유화에 이용된 담즙산염 → 회장에서 효율적으로 재흡수 → 문맥 → 간으로 들어감 → 간
+ 다른 담즙 성분과 함께 담관으로 분비 → 지질의 유화에 재사용되는 현상 → 담즙산염의 장간순환
(enterohepatic circulation)이라 부름
• 하루에 15~30g의 담즙산염이 간에서 십이지장으로 분비
• 95%이상이 재 흡수되고 약 0.5g만이 대변으로 손실됨
2. 아이코사노이드의 대사

• 탄소 수가 20개인 지방산이 산화되어 생긴 물질 → 프로스타글란딘, 트롬복산, 류코트라이엔, 리폭신 등
• 낮은 농도로도 다양한 생리적 기능을 수행함 → 염증성 반응, 통증과 발열, 혈압 조절, 혈액 응고, 분만 신
호
, 수면 가상 주기의 조절 등
• 대부분 아이코사노이드들은 아라키돈산으로부터 생성
• 고리산소화효소(COX), 리폭시제나아제(LO), 에폭시나아제가 작용하는 세 가지 경로로 생성됨
1) 아라키돈산의 생성과 이용

• 아라키돈산은 n-6 지방산인 리놀레산(linoleic acid)으로부터 생성됨
• 탈포화효소와 장쇄화효소의 작용에 의해 생성, 세포막의 인지질에 결합된 상태로 존재
• 포스포리파아제 A2(PLA2)가 인지질의 2번 탄소에 있는 아실기를 가수분해하여 아라키돈산이 떨어져 나오도
록 함
• 어떤 종류의 지방산이 기질로 이용이 되느냐에 따라 생성되는 프로스타노이드라 종류가 달라짐
• 이중결합 3개가 기질로 이용 → 1계열의 프로스타노이드 생성
• 이중결합 4개가 기질로 이용 → 2계열의 프로스타노이드 생성
• 이중결합 5개인 EPA가 이용되면 → 3계열의 프로스타노이드가 생성
2) 고리산소화효소에 의한 아이코사노이드의 생성
• 고리산소화효소(COX)에 의해 생성되는 프로스타노이드 → 프로스타글란딘(PG), 프로스타사이클린 및 트롬
복산(TX)
• 고리산소화효소는 프로스타글란딘 H 합성효소(PGHS)의 일반명, 두 가지의 효소 활성을 가지고 있음
• 고리산소화효소로서 이 작용에 의해 아라키돈산에 O2 두 분자가 첨가되어 사이클로펜텐 고리 구조를 가진
PGG2가 생성, PGG2는 15번 탄소에 과산화기를 가지고 있음
• 과산화효소로서 PGG2에 작용 → 15번 탄소의 과산화기(-OOH)를 수산기(-OH)로 전환, PGH2 정도에 따라
여러 가지 다른 프로스타글란딘, 트롬복산으로 전환시킴
• 고리산소화효소(COX) → COX-1, COX-2의 두 가지 동위효소(isozyme)이 있음
• COX-1 : 거의 대부분의 조직에서 항상 발현됨 → 위점막 조직의 항상성 유지, 혈소판 응집, 신장기능의 항
상성 유지 등에 필요함
• COX-2 : 사이토카인, 엔도톡신, 성장인자 등에 발현이 유발되는 효소 → 통증, 발열, 염증 반응 등에 관여
함
• 아스피린과 같은 소염제(NSAIDs)들은 COX(1,2)의 작용을 억제 → 염증 반응을 완화시킴 → 통증이나 열을
낮춤
• COX-1의 작용 억제로 인해 위 점막의 약화나 혈액 응고 시간 지연 등 소염제의 부작용이 나타나기도 함
3) 리폭시게나아제에 의한 아이코사노이드의 생성
• 아라키돈산이 리폭시게나아제의 작용을 받게 되면 → 류코트리엔, 하이드로페록시아이코사테트레노인산
(HPETE), 리폭신 등이 생성됨
• 리폭시게나아제에 의한 작용은 사이클로펜탄 고리 구조의 생성이 일어나지 않기 때문에 직선형 경로라고도
함
• 리폭시게나아제는 5-, 12-, 15 리폭시게나아제가 있음
4) 아이코사노이드들의 기능

• 몇 가지 대표적인 아이코사노이드들의 기능
• PGE2 : 대부분의 조직, 특히 신장 → 혈관 확장
• PGD2 : 뇌 → 수면 조절
• PGI2 : 혈관의 내피세포 → 혈관 확장, 혈소판 응집 억제
• PGF2α : 대부분의 세포 → 혈관 수축
• TxA2 : 혈소판 → 혈관 내피 밑층에 혈소판이 부착하고 응집, 혈관의 수축
• LTA4 : 백혈구, 혈소판, 비만세포, 심장과 폐의 혈관조직
• LTB4 : 호중구 → 혈과 낸피세포에 호중구가 부착
• 리폭신(lipoxin) : 혈관의 상피세포와 내피세포 → 항염증

'생화학' 카테고리의 다른 글
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 14. 핵산의 구조와 기능 (0) | 2022.05.04 |
|---|---|
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 13. 아미노산 및 질소대사(2) (0) | 2022.05.03 |
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 11. 지질 대사(1) (1) | 2022.05.01 |
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 10. 지질 (0) | 2022.04.30 |
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 9. 전자전달계와 산화적 인산화 (0) | 2022.04.29 |



