4강. 아미노산, 펩티드 및 단백질


※ 들어가기
• 단백질은 모든 생물의 필수 구성 성분으로, 세포를 구성하고 다양한 기능을 가지는 고분자 유기물질임
• 아미노산은 단백질을 구성하는 단위임
→ 탄소원자 + 아미노기 + 카르복실기 + 수소원자 + 곁사슬기 구조
1. 아미노산
• 표준 아미노산 : 자연계에 존재하는 다양한 아미노산 중 단백질에서 흔히 발견되는 20 종의 아미노산
• α-탄소 : 서로 다른 4개의 기능기가 결합한 탄소원자(글리신 제외) → 아미노기, 카르복실기, 수소 및 곁사
슬기를 가짐

• 키랄성(chiral) : 광학적으로 다른 특성을 가지는 2개의 거울 상 중 겹쳐질 수 없는 성질
• 입체이성질체(stereoisomer) : 키랄탄소를 가진 분자처럼 원자의 공간 배열(입체 배치)만이 다른 분자
• 글리세르알데히드 : 아미노산 입체이성질체 분류의 기준
- 수산기가 왼쪽 → L형, 오른쪽 → D형
- 타 아미노산의 경우 아미노기의 위치에 따라 명명함
• 우리몸의 단백질은 L형으로만 구성되어짐

1) 아미노산의 종류
• 아미노산은 곁사슬기의 극성과 산 또는 염기의 존재에 따라
- 비극성(중성)
- 극성(중성, 산성 및 염기성) 아미노산으로 분류
(1) 비극성 중성 아미노산

• 전하를 띠지 않아 중성
• 비극성 곁사슬기를 가지고 있어 물과 반응하지 않음
• 방향족 & 지방족 두 종류의 탄화수소 곁사슬기가 있음
- 방향족 아미노산 : 곁사슬에 방향족 고리를 가지고 있는 아미노산(페닐알라닌, 티로신, 트립토판)
- 곁가지 아미노산 : 비선형의 지방족 곁사슬기를 가지고 있는 아미노산(발린, 이소루신, 루신)
- 함황 아미노산 : 곁사슬기에 황을 포함하는 아미노산(메티오닌, 시스테인)
(2) 극성 중성 아미노산

• 중성 pH에서 수소결합을 할 수 있고 물과 잘 반응하여 친수성임
• 세린, 트레오닌, 티로신 : 수산기(-OH)로 수소결합
• 글루타민, 아스파라긴 : 산성아미노산의 아미드(-NH2)유도체, 곁사슬기가 수소결합
• 시스테인 : 술프하이드릴기(-SH)로 산소, 질소와 약한 수소결합 → 아황다리(disulfide bridge)를 형성하여
단백질 3차 구조 결정에 중요한 역할을 함
(3) 산성 아미노산

• 곁사슬기에 카르복실기를 가짐
• 카르복실기 : 양이온을 잃는 양성자 공여체 → 카르복실산염 음이온 형성 → 중성 pH에서 음전하를 띄게 됨
(4) 염기성 아미노산

• 염기성 곁사슬기를 가지고, 중성 pH에서 양성자를 받아들여 양전하를 띄게 됨
• 히스티딘 : 곁사슬 이미다졸기는 전하를 잘 띠지 않아 효소 촉매 반응을 촉진
• 리신 : 아미노기는 물로부터 양성자 받아 암모늄 이온으로 됨
• 아르기닌 : 염기성 구아디니노기는 양성자를 받아 구아디니늄이온으로 됨
(5) 아미노산 유도체

• 단백질과 비단백질 화합물에서 소량으로 발견되는데, 생체 내에서 여러 가지 다양한 생물학적 활성을 나타
냄
- 몇몇 아미노산은 단백질이 합성된 후 변형(posttranslational modification)에 의해 생성됨
- 여러 α-아미노산과 그 유도체들은 화학적 전령(chemical messenger)으로도 작용하는데, 글리신, γ-아미
노부티르산(GABA), 세로토닌(트립토판 유도체), 멜라토닌(트립토판 유도체) 등의 신경전달물질
(neurotransmitter)이 있음
※ 화학적 전령 : 전달암호(message)를 전달하는 화합물로서 호르몬, 신경전달물질, 신경펩티드를 포함
※ 신경전달물질 : 신경말단(axon)에서 방출되는 분자로 다른 신경세포 또는 근육세포의 특정 수용체에 결
합하여 그 기능에 영향을 주는 화학 신호분자
- 아미노산은 호르몬(티록신, 인돌아세트산)과 생체 대사과정(아르기닌, 시트룰린, 오르니틴)의 중간물질로
작용함
※ 호르몬 : 특정세포(내분비조직)에서 소량 생성된 후, 혈액을 통해 운반되어 표적조직이나 기관의 기능을
조절하는 화학신호분자
2) 아미노산의 산 • 염기특성과 적정
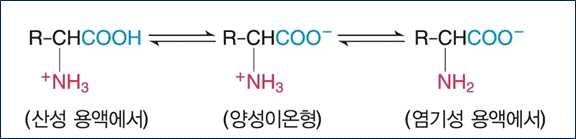
• 20개의 표준아미노산은 모두 α-아미노기와 α-카르복실기를 가지고 있음
• α-아미노기 : 양성자를 받아들임
• α-카르복실기 : 양성자를 방출함
• 아미노산은 아미노기(+)와 카르복실기(-)를 함께 가지고 있기 때문에 전체 전하는 0
• 대부분의 아미노산은 물에 용해했을 때 양성이온으로 존재함
※ 양성이온 : 양전하와 음전하를 모두 가지고 있는 분자
(1) 아미노산 적정곡선

• 아미노산을 적정할 때 적정곡선은 아미노산의 각 기능기와 수소이온사이의 반응을 나타냄
• 염기 첨가 → pH 증가 → 카르복실기 양성자를 잃어 음전하를 띄게 됨
• 수평 영역 = pH가 변하지 않는 완충영역
• 등전점(isoelectric point, pI) : 전체 전하가 0으로 전기적으로 중성일 때의 pH
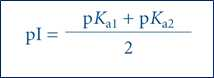

(2) 이온성 곁사슬기를 가진 아미노산의 적정

• 산성 아미노산 곁사슬기는 카르복실기를 가지고 있음
• 염기성 아미노산의 곁사슬기는 아미노기를 가지고 있음
• 글루탐산은 3개의 양성자를 낼 수 있는 산이며, 등전점은 2개 카르복실기의 pKa값의 산술적 평균에 해당함
• 리신도 3개의 양성자를 낼 수 있는 산이며, 등전점은 2개 아미노기의 pKa값의 산술적 평균에 해당함
2. 펩티드
1) 펩티드 결합

• 한 아미노산의 α-아미노기 + 다른 아미노산의 α-카르복실기의 아미드결합(amide linkage) → 물 제거 →
펩티드 결합 형성
• 펩티드 표기방법
- 유리 아미노기 말단(N-말단)은 왼쪽
- 유리 카르복실기 말단(C-말단)은 오른쪽
- 모든 아미노산 서열은 N-말단으로부터 → C-말단쪽으로
• 글리신(N-말단), 알라닌(C-말단) → 글리실알라닌
※ 펩티드결합의 특성
- 단일결합보다 짧고 강하며, 부분적으로 이중결합의 특성을 가지고 대부분 트랜스(trans-) 결합임(펩티드
결합의 공명혼성)
※ 공명혼성(resonance hybrid) : 전자의 위치만 다른 2개 또는 그 이상의 구조를 가진 분자
• 이러한 특성 때문에 카보닐 탄소 & 질소 간의 결합은 자유롭게 회전이 불가함
• α-탄소 & 아미노기 또는 카르복실기 사이는 자유롭게 회전이 가능함 → 다양한 입체배치가 가능

2) 펩티드의 종류

• 다이펩티드(dipeptide) : 2분자의 아미노산이 펩티드 결합에 의해 공유결합을 형성되는 가장 간단한 펩티드
• 글루타티온(glutathione) : 생리적으로 매우 중요한 항산화제 → 트리펩티드(tripeptide)의 일종임
3. 단백질
• 단백질은 펩티드결합으로 서로 연결된 아미노산의 긴 사슬로 구성된 거대분자
• 단백질은 기능, 화학적 조성 및 입체 구조에 따라 분류할 수 있음

• 어떤 단백질은 단백질이 폴리펩티드 사슬 외의 비아미노산 보조인자를 가지고 있음. 이들 비아미노산 성분
을 보결분자단(단백질의 생물학적 활성에 필수적인 복합단백질의 비단백질 부분, prosthetic group)이라고
하며 무기이온, 복잡한 유기화합물, 지질 당질 및 그 밖의 성분들로 되어 있음
• 보결분자단을 가지고 있는 혼합단백질을 홀로단백질(holoprotein)이라 하고, 폴리펩티드 사슬은 아포단백질
(apoprotein)이라고 함
1) 단백질의 종류

• 단백질의 구조는 대단히 복잡하여 구조적 수준에 따라 1차, 2차, 3차 및 4차 구조로 나뉨
- 1차 : 아미노산의 종류와 배열순서로 이루어지는 구조
- 2차 : 폴리펩티드 사슬 골격 이루는 원자들 공간 내 배열 구조
- 3차 : 1개의 폴리펩티드 사슬을 구성하는 모든 원자들의 공간적인 배열 구조
- 4차 : 2개 이상의 폴리펩티드 사슬로 전체적인 입체 구조
① 1차 구조


• 단백질의 1차 구조인 아미노산 서열은 단백질의 전체 성질을 결정함
• 유전적 질환은 부적절한 접힘과 정상 기능의 상실 또는 손상을 초래
(예) 겸상적혈구빈혈증 : 정상 헤모글로빈 A의 β-사슬의 6번째 글루탐산이 발린으로 바뀌어 적혈구의 모양
이 낫 모양인 빈혈, 염색체 열성 질환으로 아프리카계 미국인과 지중해인들에서 흔하며, 심한 통증과
함께 손이나 발의 부종 및 뇌졸중을 일으킬 수 있음
② 2차 구조

• 아미노산들끼리 규칙적인 배열을 형성하는데, 이러한 폴리펩티드 사슬의 펩티드결합 구성요소 간 수소결합
배열을 2차 구조라고 부름
• α-나선(α-helix) 구조 : 오른쪽으로 꼬여 있는 나선구조, 수소결합, 안정적
• β-시트(β-sheet) 구조 : 병풍처럼 주름 잡혀있는 구조, 수소결합
③ 3차 구조

• 폴리펩티드 사슬을 구성하는 모든 원자들의 3차원적인 배열 : 이황화결합(단백질 중의 두 개의 시스테인 곁
사슬의 술프하이드릴기의 산화에 의해 형성되는 결합), 소수성 상호결합, 수소결합 및 이온상호작용이 안정
화 시킴
• 단백질 변성 : 비공유성 상호작용으로 안정화된 구조의 풀림 또는 파괴
• 변성 요인 : 열, 유기용매, 기계적 혼합, 강산 또는 강염기, 세제 등
• 대부분의 단백질은 변성 후 생물학적 활성 소실
• 가역적 변성
- RNA 리보뉴클라아제를 β-메르캅토에탄올과 요소로 처리 → 변성
- β-메르캅토에탄올 : 이황화결합 해제, 시스테인 잔기 생성
- 요소 : 수소결합과 소수성 상호작용을 방해
- β-메르캅토에탄올과 요소 제거 시 이황화결합 재생성

④ 4차 구조

• 2개 이상의 폴리펩티드 사슬로 구성되어 있는 단백질의 전체적인 입체구조, 각각의 사슬을 소단위(subunit)
라고 부름
※ 소단위 : 단백질과 같은 커다란 물질의 각 부분(예 : 완전한 단백질을 형성하고 있는 각각의 폴리펩티드
사슬)
• 비공유결합(수소결합, 이온결합, 소수성 상호작용)에 의해 유지된 소단위는 독립적이고 협동적으로 작용함
2) 단백질의 형태적 분류 : 구상 단백질

① 헴의 구조
• 폴리펩티드 사슬이 구형으로 접혀진 단백질, 수용성, 빽빽한 구조
(예) 효소, 폴리펩티드 호르몬, 면역글로불린, 헴 단백질 등
• 헴 단백질인 헤모글로빈과 미오글로빈의 보결분자단의 헴기는 산소와 가역적으로 결합
② 미오글로빈의 구조와 기능

• 구조
- 전체 폴리펩티드 사슬의 대부분인 80%가 α-나선 구조로 접혀진 조밀한 분자로 구성
• 기능
- 심근과 골격근에 존재하며 산소를 저장함
- 근육세포 내에 산소의 수송 속도를 증가시키는 산소 운반
③ 헤모글로빈의 구조와 기능

• 구조
- 헤모글리빈 A는 α-사슬 2개와 β-사슬 2개가 결합된 총 4개의 폴리펩티드 사슬로 구성
- 각각의 소단위는 α-나선 구조로 헴 결합 포켓을 가짐
• 기능
- 적혈구에서만 발견되며 폐에서 조직의 모세혈관까지 산소를 운반하는 것이 주된 기능
④ 미오글로빈, 헤모글로빈과 산소의 결합

• 미오글로빈은 한 개의 헴기만 가지고 있기 때문에 한 분자의 산소와 결합
• 헤모글로빈은 4개의 헴기에 각각 산소가 한 분자씩 결합해 총 4개의 분자와 결합
• 각각 다른 산소 분압(pO2, x축)에서 측정된 포화정도(y축)의 그래프를 산소해리곡선이라 부름
- 미오글로빈(쌍곡선), 헤모글로빈(S자)
• 산소해리곡선은 S자(sigmoidal)모양일수록 산소와 협동적으로 결합하는 것을 의미함
• pH, CO2, BPG의 농도에 따라 산소해리곡선이 달라짐
※ 보어효과 : 헤모글로빈에 CO2나 수소이온이 결합하여 산소결합도가 낮아지는 현상
- 헤모글로빈에서 산소의 협동결합(cooperative binding)은 산소분압 변화에 비교적 민감하게 반응하여 헤
모글로빈이 조직에 보다 많은 산소를 수송할 수 있도록 함

※ 협동결합 : 결합 부위가 여러 개 있는 단백질에 첫 리간드가 결합하면 그 다음 리간드의 결합을 촉진하
는 현상
2) 단백질의 형태적 분류 : 섬유상 단백질
• 섬유상 단백질의 특징
- 폴리펩티드 사실이 긴 가닥 또는 얇은 층으로 된 막대형태의 단백질, 물에 잘 녹지 않고 물리적으로 단단
함
- 신체를 보호하고 지탱시켜주며 외형과 형태를 결정
- 콜라겐, α-케라틴, 피브로인, 엘라스틴 등
① 콜라겐(collagen)
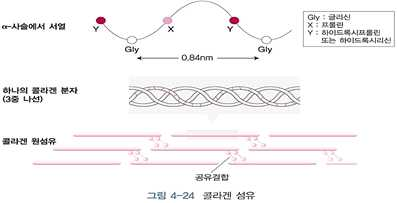
• 뼈와 결합조직의 구성성분, 인체에서 가장 풍부한 단백질
• α-사슬 형태의 3개 폴리펩티드가 3중 나선 구조 형성
- 프롤린 : 나선을 꼬이게 함
- 글리신 : 3번째 마다 반복 위치
- 프롤린, 리신 잔기 수산화 : 구조 안정화에 중요한 역할을 함
※ 결합조직 : 세포간 물질과 다양한 종류의 세포로 구성된 조직으로, 신체의 거의 모든 장기와 조직을 지
지해주고 결합해주는 역할
※ α-사슬 : 콜라겐에만 있는 독특하게 반복되는(-Gly-X-Y-) 이차구조로 반복 서열마다 1회전하는 좌선성
의 나선 구조
② α-케라틴(α-keratin)

• 머리카락, 털, 피부, 손톱 및 뿔 등의 구성성분
• 종류 I형 + II형 → 코일 이합체 형성 → 프로토필라멘트 거대섬유 형성 → 섬유(fiber) 형성
- 나선 구조를 안정화시키는 알라닌과 루신 함량이 높아서 규칙적인 구조 가짐
- 소수성 아미노산으로 물에 잘 녹지 않고, 이황결합 때문에 잘 늘어나지 않음
③ 실크 피브로인(fibroin)

• 곤충과 거미에 의해 생성
• 피브로인의 폴리펩티드 사슬은 주로 알라닌과 글리신 잔기가 풍부한 역평행 β-시트층으로 구성됨
• 수소결합과 반데르발스힘에 의해 안정화됨
• 비교적 많은 약한 결합 때문에 유연성이 존재함
④ 엘라스틴(elastin)

• 무질서하게 꼬인 구조이며, 콜라겐과 함께 주로 인대조직, 동맥혈관의 벽 등에 존재함
• 외부의 힘이 가해졌을 때 고무와 비슷한 탄력성, 복원성을 가지나 강도는 약함
• 분자 내에 극성 곁사슬기가 적음
• 비극성 아미노산인 글리신, 루신, 페닐알라닌 및 프롤린 등이 많음
3) 단백질의 분리 및 정제 기술
※ 먼저 준비해야 할 것들
- 단백질의 물리적 성질이나 아미노산 개수, 종류 및 서열을 확인하기 위해서 우선 균일한 추출물을 준비함
- 세포의 세포막이나 세포벽에 둘러싸인 상태로는 화학적인 분리가 힘들기 때문에 세포 파괴를 통해 순수
한 단백질 용액상태로 만드는 것이 필요함(조추출물)
- 추출물이 준비된 후 여러 가지 방법을 이용하여 분리
- 정밀정제법에는 크로마토그래피와 전기영동 등의 방법이 있음
(1) 단백질의 분리기술

• 단백질을 정제하기 전 세포를 파괴하는 균질화 과정을 통해 단백질을 추출함
- 믹서기로 갈기, 균질기 사용 및 초음파 분해방법
• 균질화 → 분획원심분리(differential centrifugation)
• 단백질이 용해된 후에는 초벌정제 수행 → 고농도의 염을 첨가하여 단백질을 침전(염석) or 투석방법을
이용함
(2) 단백질의 정제기술 : 크로마토그래피


• 화합물들이 서로 다른 두 가지 상 사이에 분배될 때, 그 분배된 정도가 화합물들 끼리 서로 다르다는 사실
에 근거하여 분리하는 방법(고정상, 이동상)
- 크기별 분리 크로마토그래피(= 겔 여과 크로마토그래피) : 분자량이 다른 단백질을 가려낼 때 유용함
- 이온교환 크로마토그래피 : 전하에 따라 분리
- 친화 크로마토그래피 : 항체 & 항원 등 특이적 친화성을 이용
(2) 단백질의 정제기술 : 겔 전기영동


• 전하를 띤 입자가 전기장에서 이동한다는 것에 근거하여, DNA & RNA, 단백질과 같은 큰 분자를 전류를 흘
려주어 겔 내부에서 이동시켜 크기에 따라 서로 분리하는 방법
- 아가로오스 겔 전기영동 : DNA, RNA 분리에 사용, 인산기 → 양전하 이동속도에 의해 분리
- SDS-PAGE-폴리아크릴아미드 겔 전기영동 : 단백질 분자량 측정시 사용, SDS의 음이온이 단백질의 분
자량에 비례하여 결합 → 이동속도에 차이
※ 아가로오스(agarose) : 한천 중에 다량으로 함유되어 있는 다당류 중합체로, 반복하는 단위는 3,6-무수
-L-갈락토오스(β1→4) 연결된 D-갈락토오스로 구성. 아가로오스 부유액을 가열하고 나서 식히면 겔 상
태가 되고, 이 겔은 3차원적 교차구조를 가지고 있어 고분자 물질도 자유롭게 확산되기 때문에 전기영동
의 지자체나 결 여과 크로마토그래피의 충전제로 이용할 수 있음
※ SDS(sodium dodecyl sulfate) : 단백질에 대해 강력한 친화성이 있어 단백질의 소수성 부분에 결합하여
dam전하를 띠게 하고 단백질을 변성시키는데 자주 사용되는 임이온 계면활성제
<확인문제>
문제 1. 다음 중 필수 아미노산은 무엇인가?
① 트립토판
② 메티오닌
③ 리신
④ 위의 세 가지 모두
정답 ④
문제 2. 다음 중 단백질에 대한 설명으로 옳지 않은 것은?
① 단백질은 효소나 호르몬 또는 항체로 작용한다.
② 어떤 단백질은 폴리펩티드 사슬 외에 비아미노산 보조인자를 가지고 있다.
③ 단백질은 아미노산이라는 기본단위의 분자가 결합한 것이다.
④ 단백질을 가수분해하면 D-amino acid로 된다.
정답 ④
문제 3. 다음 중 3중 나선구조를 갖고 있는 섬유상 단백질은 무엇인가?
① 콜라겐
② 케라틴
③ 엘라스틴
④ 효소단백질
정답 ①
문제 4. 다음 중 Peptide 결합을 설명한 것 중 옳은 것은?
① 펩티드결합은 단일 화합물이다.
② 같은 아미노산에 있는 아미노기와 카르복실기의 결합이다.
③ 유리 아미노기 말단(N-말단)은 오른쪽에, 유리카르복실기 말단(C-말단)은 왼쪽에 쓴다.
④ 두 아미노산의 펩타이드결합을 다이펩타이드라고 한다.
정답 ④
문제 5. 두 개의 시스테인간 강력한 결합의 일종으로 단백질 3차 구조를 안정화시키는데 크게 기여하는 결합
은 무엇인가?
① 수소결합
② 소수성 상호작용
③ 이황화결합
④ 이온 상호작용
정답 ③
문제 6. 아미노산에서 양(+) 및 음(-) 전하의 이온이 같을 때, 용액의 pH를 의미하는 것은 무엇인가?
① 평형점
② 등전점
③ 변성
④ 전기영동
정답 ②
문제 7. 다음 중 헤모글로빈의 구성성분으로 옳지 않은 것은?
① 포르피린
② 철
③ 히스티딘 잔기
④ 구리
정답 ④
문제 8. 다음 중 펩티드결합에 대한 설명 중 옳은 것으로 묶인 것은?
㉮ 모두 이중결합이다. ㉯ 회전이 자유로운 결합이 아니다.
㉰ 탄소 간의 길이가 단일 결합보다 길다. ㉱ 대부분 트랜스(trans) 결합이다.
① ㉮㉯㉰㉱
② ㉮㉰
③ ㉯㉱
④ ㉮㉯㉰
정답 ③
'생화학' 카테고리의 다른 글
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 6. 탄수화물 (0) | 2022.04.26 |
|---|---|
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 5. 효소 (0) | 2022.04.25 |
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 3. 생체에너지학 (0) | 2022.04.23 |
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 2. 물 (0) | 2022.04.21 |
| 식품, 화학 관련 전공 및 시험대비 생화학 핵심 요점 요약 정리 1. 세포 (0) | 2022.04.20 |



